O que é o pH?
As soluções podem ser classificadas como ácidas, básicas ou neutras, de acordo com o seu caráter químico.
Mas como saber qual é a mais ácida de duas soluções ácidas? E a mais básica (alcalina) de duas soluções básicas?
Esta indicação é dada por uma escala, a escala de pH, que varia entre 0 e 14, de acordo com a imagem que se segue. Esta escala GRADUA o caráter mais ácido ou mais básico de duas soluções.
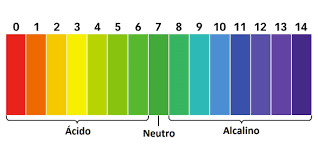
De uma forma simplista, esta escala é baseada na concentração de iões H+ e OH- das soluções. ASSIM:
SOLUÇÕES ÁCIDAS:
Quanto menor o pH de uma substância, maior a concentração de íons H+ e menor a concentração de íons OH-.
Visualizando na escala acima, uma solução ÁCIDA, à medida que se afasta do NEUTRO, é cada vez mais ácida, ou seja, tem menor pH.
Os ácidos mais vulgares têm, na sua fórmula química, H no início. (nunca esquecer que as fórmulas químicas das substâncias iónicas começam sempre com o ião positivo, neste caso é H+).
Exemplos:
HNO3, HCl, H2SO4
SOLUÇÕES BÁSICAS:
Quanto maior o pH de uma substância, maior a concentração de íons OH- e menor a concentração de íons H+.
Visualizando na escala acima, uma solução BÁSICA, à medida que se afasta do NEUTRO, é cada vez mais básica, ou seja, tem maior pH.
As bases mais vulgares (os hidróxidos) têm a sua fórmula química terminada em OH (nunca esquecer que as fórmulas químicas das substâncias iónicas começam sempre com o ião positivo, e então o negativo, neste caso OH-, vem no fim).
Exemplos:
NaOH, Ca (OH)2, NH3OH
Como se determina o pH?
Há aparelhos que medem o pH de forma direta, sendo necessário calibrá-los corretamente.
Nos laboratórios das escolas, o mais vulgar é a utilização de indicador universal, quer em solução (fig1 a e b), quer em suporte de papel (tiras) (fig 2).
Estes são uma mistura de indicadores de pH em solução, ou secos em tiras de papel absorvente. Essas tiras apresentam distintas cores para cada pH, numa uma escala de 1 a 14. Comparam-se então as cores obtidas com escalas que acompanham o indicador, a chamada escala de Sorensen.
Fig 1a Fig 1 b Fig 2